
「塩野義製薬の経口新型コロナウイルス治療薬の承認が見送りになった」というニュースが話題になりました。
今回、承認が審議された新型コロナウイルス治療薬ゾコーバ錠はエンシトレルビルを有効成分にもつ3CLプロテアーゼ阻害薬です。ウイルス特有の酵素を阻害することで、新型コロナウイルスの増殖を抑制します。
ゾコーバ錠は今年5月の薬機法改正で新設された「緊急承認制度」の適応を求めて申請されていました。
今回は緊急承認制度がどのような制度か説明した上で、ゾコーバ錠に対する適用が認められなかった理由について、徹底解説!したいと思います。
新型コロナウイルスの感染症が拡大する中、国内で開発されている未承認の医薬品を速やかに承認する制度の新設が求められました。その結果、薬機法の改正が行われ、緊急承認制度が新設されました。緊急承認制度は、緊急時に必要とされる薬剤であれば、第Ⅲ相臨床試験の結果を待たずに、安全性の確定・有効性の推定があれば承認を行うことを可能とする制度です。この制度を利用して申請が行われたのが塩野義製薬の経口新型コロナ治療薬ゾコーバ錠でした。何故、ゾコーバ錠の緊急承認は見送られてしまったのか?緊急承認制度のルールに照らし合わせて解説しています。
1、緊急時の薬事承認制度が検討された経緯
新型コロナウイルス感染症の拡大に伴い、様々な医薬品が特例承認されましたが、国産の医薬品を迅速に承認するためには新たな制度が必要でした。その結果、令和4年5月の薬機法改正で追加されたのが医薬品の「緊急承認制度」です。
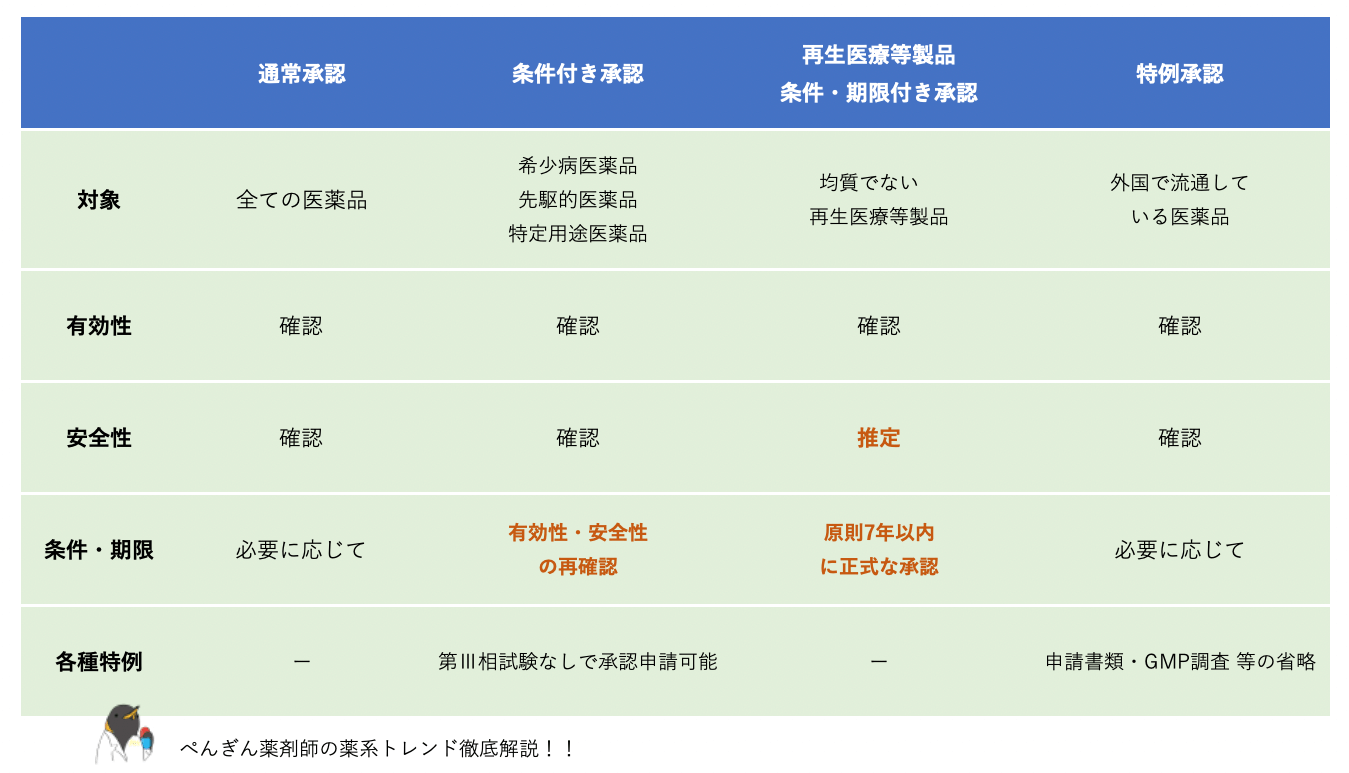
緊急承認制度が導入されるまで、日本の医薬品承認制度は大きく4種類(通常承認を含む)に分けられました。
そのうち、承認に必要なプロセスの省略を可能とする制度は以下の3つです。
・条件付き承認制度(条件付き早期承認制度)
・再生医療等製品:条件及び期限付承認制度
・特例承認制度
このうち、「条件付き承認」と「再生医療等製品:条件及び期限付承認」については対象となる適応の性質上「必要性が高いが十分な人数を対象とする臨床試験の実施が困難である」場合に、第Ⅲ相臨床試験を省略して申請・審査を行えるようにするためのものです。
「特例承認」は「①疾病のまん延防止等のために緊急の使用が必要」であり、「②当該医薬品の使用以外に適切な方法がなく」、「③海外で販売等が認められている医薬品について」通常の審査に必要な手続きを大幅に省略して承認できる制度です。
緊急承認制度を除く医薬品承認制度を表にまとめてみました。
新型コロナウイルス感染症(COVID-19)の治療薬やワクチンについては、そのほとんどが海外で承認されたもので、国内の感染拡大を受けて緊急的に導入する必要があったために特例承認制度の対象となっています。


